

|
单细胞测序技术服务 靶向lncRNA单细胞全转录组测序 单细胞全转录组测序 |
|
生物分子凝聚体研究 HyPro靶RNA临近标记技术 |
|
RNA-蛋白相互作用 CHIRP – MS RNA pull-down MS HyPro - MS |
RNA-RNA/DNA相互作用 CHIRP-seq HyPro-seq/芯片 |
蛋白-RNA相互作用 RIP seq/芯片 AGO APP seq/芯片 |
蛋白-蛋白相互作用 CoIP-MS/AP-MS |
|
DNA-蛋白相互作用 DNA pull down-MS |
|
NGS测序技术服务 DRIPc-seq |
|
NGS测序技术服务 环状DNA测序 |
|
基因芯片技术服务 Small RNA修饰芯片 m6A单碱基分辨率芯片 mRNA&lncRNA表观转录组芯片 circRNA表观转录组芯片 |
NGS测序技术服务 表观转录组学测序服务 RNA m6A甲基化测序(MeRIP Seq) |
LC-MS mRNA碱基修饰检测 tRNA碱基修饰检测 |
PCR技术服务 MeRIP-PCR技术服务 m6A绝对定量RT-PCR技术服务 m6A单碱基位点PCR(MazF酶切法)技术服务 |
|
NGS测序技术服务 DNA(羟)甲基化测序(抗体法) DNA甲酰基胞嘧啶(5fc)修饰测序 DNA 5hmC 测序(化学法) 染色质免疫共沉淀测序 |
PCR技术服务 MeDIP-qPCR hMeDIP-qPCR ChIP-qPCR |
|
Ribo-seq |
核糖体-新身肽链复合物(RNC) |
|
蛋白表达定量 PRM靶向定量 TMT标记定量技术 非标定量技术 |
蛋白修饰定量 TMT标记定量乙酰化 TMT标记定量泛素化 Labelfree非标定量泛素化 Labelfree非标定量乙酰化 TMT标记定量磷酸化 非标定量磷酸化 |
RNA/蛋白-蛋白相互作用 HyPro靶RNA临近标记技术 蛋白-蛋白相互作用 |
蛋白质并非孤立存在的生物分子,而是具有特定三维空间结构并与其他蛋白质相互作用,共同执行功能。因此,蛋白质的模块及空间组织与其表达水平具有同样的重要性。为了解析蛋白质组的组织结构单元而开发的基于质谱的蛋白质组学方法通常结合了质谱检测与各种生化试验。其中最经典的技术为1999[1]首次报导的亲和纯化-质谱技术(affinity purification – mass spectrametry,AP-MS)。既可进行大规模的protein interactome 构建[2],也能针对特定条件下特定蛋白质的互作进行差异分析、时间动态分析等[3]。
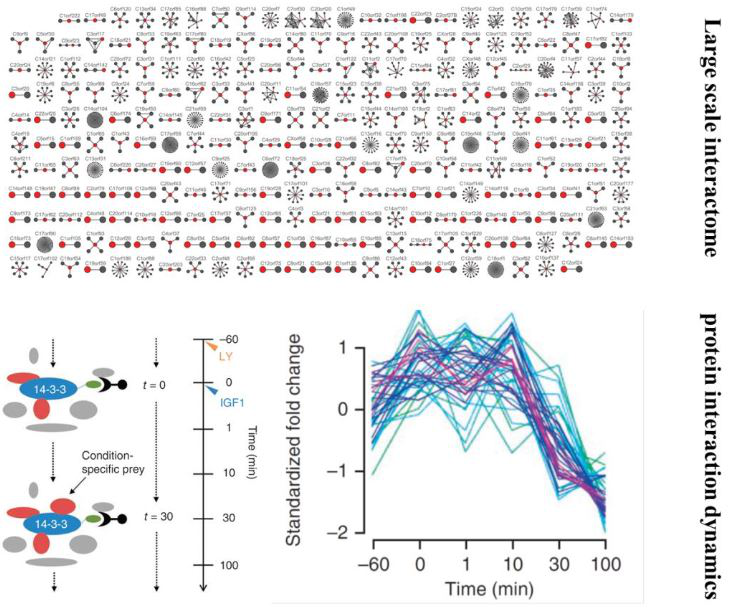
图1:AP-MS 技术的两种运用。
参考文献
[1]. Rigaut, G.; Shevchenko, A.; Rutz, B.; Wilm, M.; Mann, M.; Seraphin, B., A generic protein purification method for protein complex characterization and proteome exploration. Nature biotechnology 1999, 17 (10), 1030-2.
[2]. Huttlin, E. L.; Ting, L.; Bruckner, R. J.; Gebreab, F.; Gygi, M. P.; Szpyt, J.; Tam, S.; Zarraga, G.; Colby, G.; Baltier, K.; Dong, R.; Guarani, V.; Vaites, L. P.; Ordureau, A.; Rad, R.; Erickson, B. K.; Wuhr, M.; Chick, J.; Zhai, B.; Kolippakkam, D.; Mintseris, J.; Obar, R. A.; Harris, T.; Artavanis-Tsakonas, S.; Sowa, M. E.; De Camilli, P.; Paulo, J. A.; Harper, J. W.; Gygi, S. P., The BioPlex Network: A Systematic Exploration of the Human Interactome. Cell 2015, 162 (2), 425-40.
[3]. Collins, B. C.; Gillet, L. C.; Rosenberger, G.; Rost, H. L.; Vichalkovski, A.; Gstaiger, M.; Aebersold, R., Quantifying protein interaction dynamics by SWATH mass spectrometry: application to the 14-3-3 system. Nat Meth 2013, 10 (12), 1246-1253.
使用亲和标签(AP-MS) 或特异性抗体 (CoIP-MS),在native条件下纯化与目标蛋白质相互作用的蛋白,进而使用质谱进行鉴定,通过test\control比对,过滤非特异结合蛋白,定性定量分析与特定蛋白质直接或间接作用的蛋白质。同时,结合 LFQ/TMT等定量技术,可以方便的研究特定蛋白互作关系随时间的变化情况。
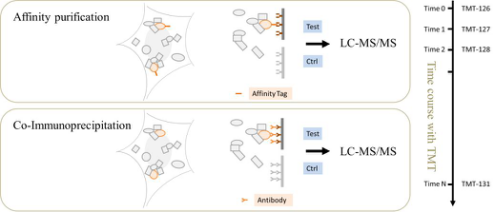
图2:AP-MS 技术实验原理。
1. 哈佛大学Steven P. Gygi教授实验室运用高通量AP-MS技术,进行了2594组AP-MS实验,鉴定了23744个相互作用,包括了7668个蛋白质,为研究蛋白尤其是功能未知蛋白提供了重要参考意义。
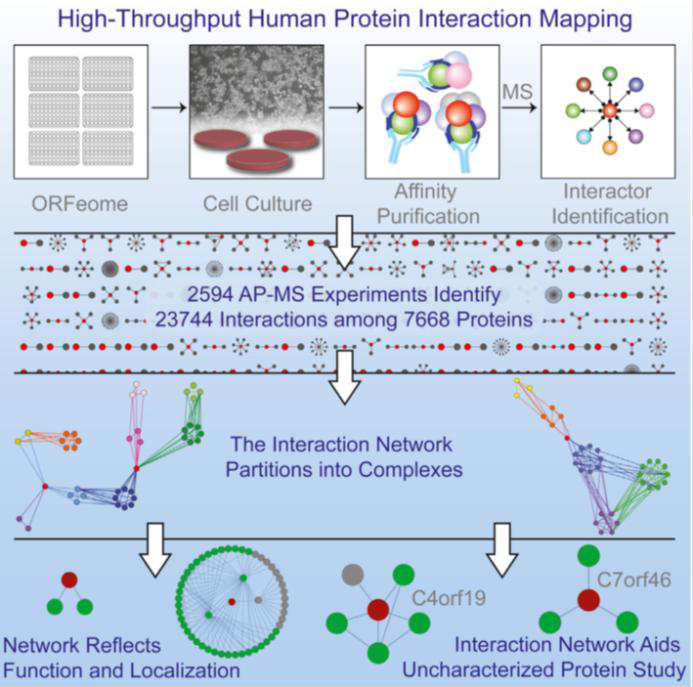
图3:高通量AP-MS技术
2. 为了更好的了解生物学过程的内在动态变化情况,苏黎世联邦理工学院的Ruedi Aebersold教授实验室运用AP-MS技术研究了14-3-3b scaffold protein 的蛋白互作组在IGF1刺激下,insulin-PI3K-AKT信号通路随时间的动态变化过程。[3]
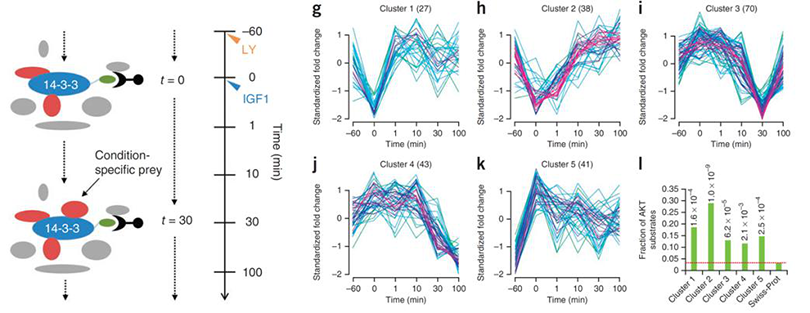
图4:运用AP-MS研究14-3-3 scaffold protein 互作蛋白的时间动态关系,发现5种不同的cluster模式,对研究该信号通路的动态变化过程具有重大指导意义。
| Sample | Amount | Antibody |
|---|---|---|
| Tissue | 200 mg | Yes |
| Cell | 2×107 | Yes |
| Cell (tag) | 2×107 | No |

